हमारी प्रकृति में पाए गए ऐसे बहुत से तत्व है जो हमारे लिए बेहद ही महत्वपूर्ण है ठीक उन्हीं में से कुछ तत्व रासायनिक तत्व होते हैं जिनका उपयोग हमारे निजी जीवन व बहुत सारी ऐसी वस्तुओं में होता है जो हमारे लिए बेहद उपयोगी होती है यह पांच प्रमुख श्रेणियां में बांटे जाती है जैसे धातु अधातु उपधातु गैस परमाणु तथा तनाव तत्व या हम विशेष रूप से धातु और अधातु की बारे में आपको बताएंगे कि यह क्या होते हैं और उनके गुणधर्म कैसे होते हैं इनका मानव जीवन एवं उद्योग में कैसा महत्व है और धातु और अधातु में मुख्य अंतर यहां हम आपको बताएंगे
धातु
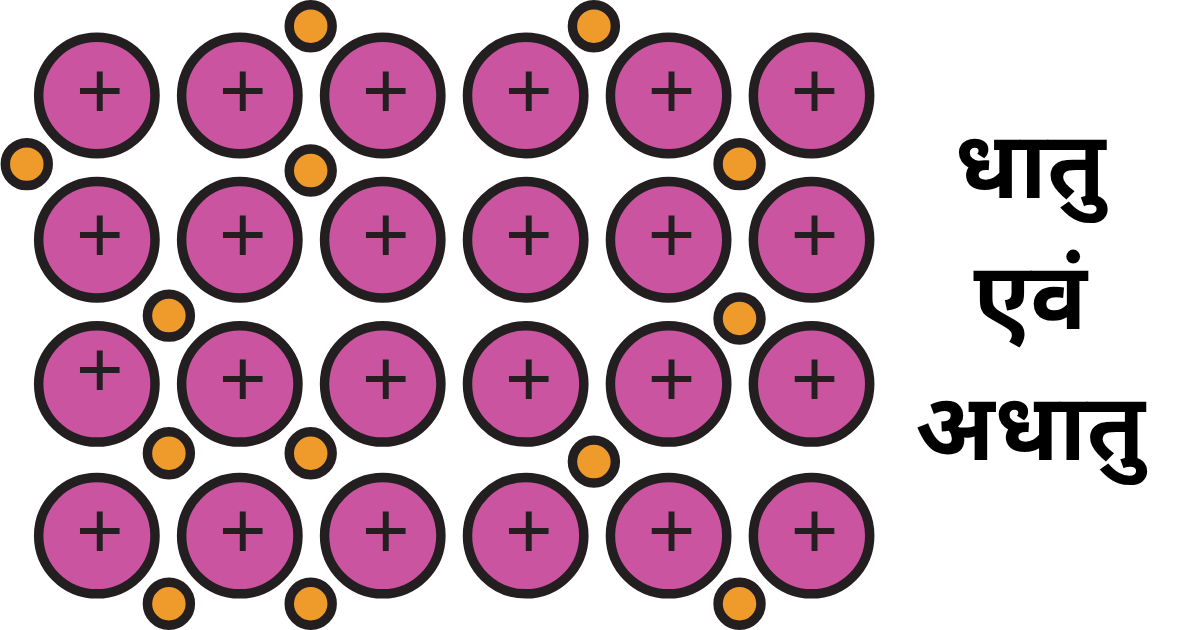
धातु ऐसे तत्वों को कहते हैं जिनके परमाणुओं में कुछ विशिष्ट प्रमुख गुण पाए जाते हैं जैसे विद्युत धनात्मक, उच्चतम तन्यता व आघात वर्धकता, चमकदार सतह, ऊष्मा एवं विद्युत का सुचालक, उच्च गलनांक एवं क्वथनांक, ठोस अवस्था,
1. विद्युत धनात्मकता -यह धातु तत्व आसानी से इलेक्ट्रॉन का त्याग करते हैं जिससे यह धनायन बनाते हैं
2. उच्च तन्यता व आघात वर्धकता – धातु को हथोड़ा या किसी दबाव से पीटा जा सकता है चादर बनाई भी जा सकती है और इसे तार खींचने में भी कार्य रत कर दिया जाता है
3. चमकदार सतह – यदि इस धातु पर पॉलिश किया जाए तो इसकी सतह चमकदार दिखाई देती है
4. उसका एवं विद्युत का सुचालक – यह धातु ऊर्जा और बिजली जैसी गर्मी को अच्छी तरीके से खुद में प्रवाहित कर लेते हैं
5. कुछ गलनांक एवं क्वथनांक – इन धातुओं का गलनांक व्यक्गनात्मक सदैव ऊंचा ही रहता है
6. ठोस अवस्था -सामान्य ताप पर अधिकांश से वस्तुएं ठोस अवस्था में पाई जाती हैं जैसे मरकरी (Hg) इसका अपवाद है जो कैमरे तापमान पर द्रव अवस्था में रहता है
7. घनत्व-धातु का घनत्व हमेशा अधिक ही होता है
धातु के कुछ महत्वपूर्ण उदाहरण
1. सोना (Au)
2. लोहा (Fe)
3. चांदी (Ag)
4. तांबा (Cu)
5. अल्युमिनियम (AI)
6. सीसा (Pb)
7. पारा (Hg)
8. जस्ता (Zn)
9. टाइटेनियम (Ti)
10. मैग्नीशियम (Mg)अधातु
अधातु में धातु होती हैं जिनमें धातु जैसे कोई गुण नहीं पाए जाते हैं बल्कि यह धातु से बहुत ही ज्यादा विपरीत होती हैं उसे अधातु कहते हैं
अधातु में भी धातु की तरह कुछ विभिन्न गुण पाए जाते हैं जैसे विद्युत अनुकरण, चमकहीन, भंगुरता, घनत्व कम होना, अवस्था में विविधता, गलनांक एवं क्वथनांक कम
1. विद्युत अनुकरण – अधातु विद्युत ऊष्मा के अच्छे संचालक नहीं होते हैं यह अच्छे कुचालक होते हैं
2. चमकहीन -अधातु पॉलिश के बाद सामान्य चमक नहीं देते हैं यह अपवाद होते हैं
3. भंगुरता – अधातु ज्यादातर भंगुर होते हैं यह पीटने के बाद टूट जाते हैं इनका कोई तार व कोई अन्य वस्तु नहीं बनती है
4. घनत्व कम होना -अधातु का धातुकी तुलना मैं घनत्व बहुत कम होता है
5. अवस्था में विविधता – अधातु ठोस अवस्था में द्रव अवस्था में वह गैस अवस्था में होते हैं जैसे ऑक्सीजन गैस ब्रोमीन द्रव
6. गलनांक एवं क्वथनांक कम- धातु की तुलना में अधातु के गलनांक व क्वथनांक सामान्यतः काम होते हैं
अधातु के कुछ सामान्य उदाहरण
1. हाइड्रोजन (H2)
2. कार्बन( C)
3. आयोडीन( I2)
4. क्लोरीन( Cl2)
5. फास्फोरस( P)
6. सल्फर(S )
7. ऑक्सीजन( O2)
8. नाइट्रोजन(N2) धातुओं का उपयोग ज्यादातर भवन निर्माण यातायात एवं वाहन क्षेत्र परिचालन उपकरण विशेष धातुएं कीमती धातुएं उपकरण एवं बर्तन बनाने में किया जाता है धातुओं के इस्तेमाल में लोहा इस्पात अल्युमिनियम का उपयोग ज्यादातर स्तंभ ट्रस्ट फ्रेम आदि बनाने में किया जाता है वह इंजन पार्ट्स चेसिस पहिए बॉडी में अन्य संरचनाओं यह भी धातुओं से ही बनती है विद्युत के तार मोटर जनरेटर ट्रांसफॉर्म आदि तांबा विद्युत चालकता के लिए एक उत्कृष्ट उदाहरण है यह कूकवारे बर्तन औजार मशीनरी भाग और औद्योगिक की उपकरण बनाने में भी धातुओं का उपयोग किया जाता है वह आभूषण सोना चांदी प्लैटिना मोदी निवेश हेतु भी धातुएं उपयुक्त में आदि हैं धातुएं विशेषता टाइटेनियम निखिल आदि उत्सव पर कोरोजन प्रतिरोध वाले क्षेत्रों में आते हैंधातु और अधातु दोनों ही प्राकृतिक के महत्वपूर्ण घटक है धातु के गुण हमें निर्माण उच्च संरक्षण संरचनात्मक मजबूती और प्रौद्योगिकी में मदद करते हैं जबकि अधातु की भूमिका जीवन रसायन और पर्यावरण संतुलन बनाने में अहम होती है अध्ययन करके यह जाना जा सकता है कि जब किसी प्रकार का तत्व उपयुक्त होगा और किस प्रकार की मिश्रण या सुरक्षा उपाय किए जाने चाहिएधातुएं आमतौर पर ऊष्मा और विद्युत की सुचालक आघात वर्धनीय और तान्या होते हैं जो उन्हें विभिन्न औद्योगिक अनुप्रयोगों के लिए आदर्श बनाते हैं इसके विपरीत अधातु कुचालक होती है ठोस रूप से भंगुर और अक्सर अभिक्रिया के साथ ऋण आत्मक आयन बनती है धातुएं तनु अम्ल से हाइड्रोजन को विस्थापित कर हाइड्रोजन गैस को निर्मित करती है जबकि अधातु ऑक्साइड तनु अम्ल से हाइड्रोजन को विस्थापित नहीं करती धातु ऑक्साइड आयोनिक होते हैं धातुएं मरकरी के अतिरिक्त सभी कक्ष ताप पर ठोस रूप में होते हैं जबकि अधातु में तीनों अवस्था में व्यापक ब्रोमीन तरल अधातु होती हैं धातुओं मेंसामान्य उच्च घनत्व लेकिन सोडियम और पोटेशियम का घनत्व कम होता है जबकि अधातु का घनत्व अपेक्षाकृत कम ही होता है धातुएं सामान्य कठोर ठोस होती है प्रत्येक धातु की कठोरता अलग-अलग होती है धातुओं का गलनांक भी अधिक होता है जबकि अधातु सामान्य या तो ठोस होती हैं या फिर गैस यह होती हैं सामान्य धातुओं को वायु में दहन चमकदार ज्वाला के साथ होता है तथा लगभग सभी धातुएं ऑक्सीजन से साथ मिलकर संगत धातु के ऑक्साइड बनती है पृथ्वी से खनिज अयस्कों में मिट्टी रे दादी जैसे कहीं अशुद्धियां होती हैं जिन्हें गैंग कहते हैं अयस्कों से गैंग को हटाने के लिए जिन प्रक्रियाओं का उपयोग होता है वह अयस्क एवं गैंग के भौतिक या रासायनिक गुण धर्म पर आधारित होती है इस पृथक्करण के लिए विभिन्न तकनीक अपनाई जाती हैंधातुएं प्रकृति में सल्फाइड या कार्बोनेट के रूप में पाई जाती है सल्फाइड या कार्बोनेट की तुलना में धातु को उसके ऑक्साइड से प्राप्त करना अधिक आसान है अतः कार्बोनेट व सल्फाइड को पहले ऑक्साइड में बदल दिया जाता है सल्फाइड अयस्क कोड वायु की उपस्थिति में अधिक ताप पर गर्म करके ऑक्साइड में परिवर्तित कर दिया जाता हैधातु ऑक्साइड अधिकांश धातु ऑक्साइड मूल होते हैं और पानी में घुलकर धातु हाइड्रोक्साइड यानी शहर बनाते हैं जैसे सोडियम ऑक्साइड जबकि अधातु ऑक्साइड पानी में घोलकर अम्लीय ऑक्साइड उत्पन्न करती है जैसे सल्फर डाइऑक्साइड धातु और अधातु के बीच बनने वाले योग आयनिक होते हैं जैसे सोडियम क्लोराइड
कृषि एवं उद्योग के बारे में जानने के लिए कृषि एवं उद्योग पर क्लिक करें।
1 thought on “धातु एवं अधातु”